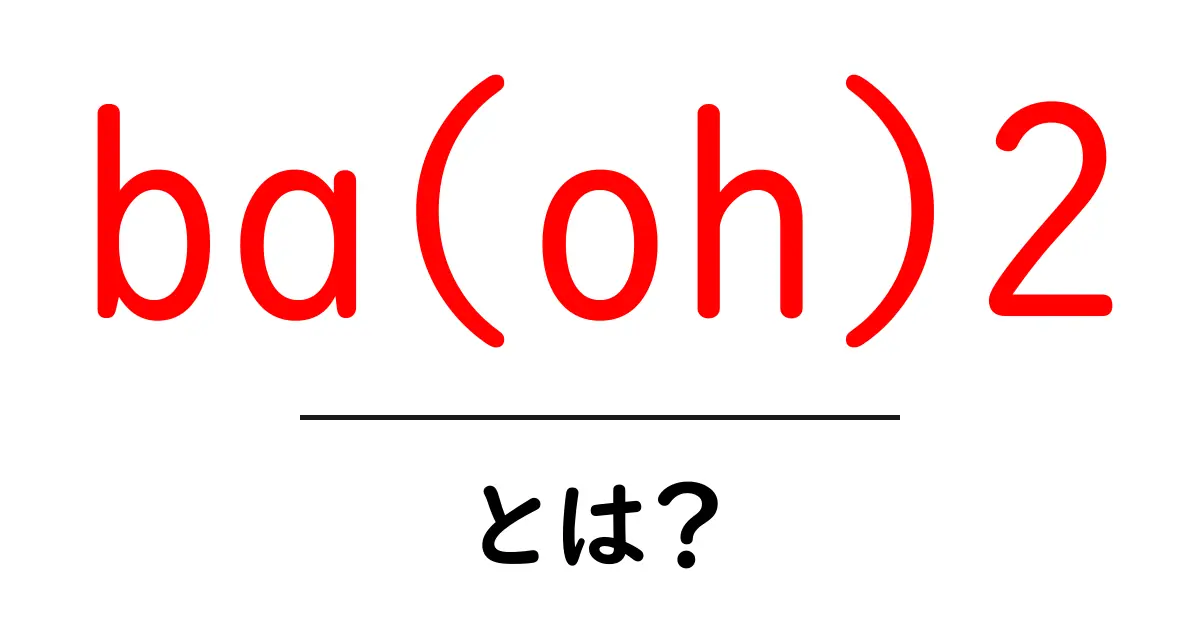

高岡智則
年齢:33歳 性別:男性 職業:Webディレクター(兼ライティング・SNS運用担当) 居住地:東京都杉並区・永福町の1LDKマンション 出身地:神奈川県川崎市 身長:176cm 体系:細身〜普通(最近ちょっとお腹が気になる) 血液型:A型 誕生日:1992年11月20日 最終学歴:明治大学・情報コミュニケーション学部卒 通勤:京王井の頭線で渋谷まで(通勤20分) 家族構成:一人暮らし、実家には両親と2歳下の妹 恋愛事情:独身。彼女は2年いない(本人は「忙しいだけ」と言い張る)
ba(oh)2とは何か
ba(oh)2、すなわちバリウム水酸化物は化学の世界でよく出てくる強い塩基の一つです。水に溶けやすく、実験室や学校の授業で酸を中和する際に使われることがあります。以下では初心者にも分かりやすく、ba(oh)2の基本情報や安全な取り扱い、身の回りでの知識を解説します。
基本情報
化学式: Ba(OH)2
分子量: 約171.33 g/mol
状態: 常温で白色の結晶性固体
水への溶解性: 高い
性質と反応
ba(oh)2は強アルカリ性を示します。水に溶かすと水酸化物イオン OH- が多く生まれ、溶液は強い塩基性になります。酸と反応すると塩と水を作る中和反応が起こります。例: Ba(OH)2 + 2HCl → BaCl2 + 2H2O。
また二酸化炭素と反応して BaCO3 の沈殿を生じることがあります。湿った環境や空気中のCO2と反応して性質が変わることにも注意が必要です。
表で見る性質
| 内容 | |
| 化学式 | Ba(OH)2 |
|---|---|
| 分子量 | 約171.33 g/mol |
| 状態 | 白色の結晶性固体 |
| 水への溶解性 | 高い |
| 安全性 | 強アルカリ性、刺激性あり |
取り扱いと安全性
ba(oh)2は強いアルカリ性の刺激性があります。皮膚や目、粘膜に触れると炎症を起こすことがあります。実験室で扱うときは手袋・保護眼鏡・換気を徹底し、乾燥した状態で扱い、こぼした場合はすぐに水で希釈して中和することが推奨されます。
水に溶かす際は必ず教育指導者の指示に従い、少量ずつ慎重に溶かしてください。熱反応を伴う場合があるため、急速な加熱は避けます。
教育現場での使い方の例
中学校の化学の授業では中和反応の実験やpHの変化観察の題材として ba(oh)2 を取り上げることがあります。適切な希釈と安全管理の下で、酸と塩と水の関係を学ぶ良い教材になります。
まとめ
ba(oh)2は強い塩基性の無機塩基です。扱いには注意が必要ですが、酸と反応して塩と水を作る基本的な化学反応を体感できる、化学の学習には欠かせない物質です。
ba(oh)2の同意語
- 水酸化バリウム
- Ba(OH)2 の日本語名。水酸化物で、強アルカリ性を示す無機化合物。無水と水和物の状態があり、用途として中和・分析・試薬などに用いられる。
- バリウム水酸化物
- Ba(OH)2 の別表記。日本語表記の一つで、同じ化合物を指す。
- バリウム水酸化物八水和物
- Ba(OH)2·8H2O の名称。水和した結晶状態で、実験室で扱われることが多い。乾燥すると無水のBa(OH)2になる。
- 無水バリウム水酸化物
- Ba(OH)2 の無水形。水分を含まない結晶で、乾燥条件で保存されることが多い。
- バリタ水
- 飽和Ba(OH)2 水溶液の俗称。旧来からの名称で、強いアルカリ性を示す水溶液として用いられる。
- 苛性水酸化バリウム
- Ba(OH)2 の別称表現。苛性(強アルカリ性)の水酸化物という意味で使われることがある。
ba(oh)2の対義語・反対語
- 酸
- Ba(OH)2 はアルカリ性の物質で、対義語は酸。酸は水素イオン(H+)を多く含み、溶液のpHを下げやすい性質を指します。
- 酸性
- 酸性は酸の性質・状態を指します。Ba(OH)2 の反対の性質として使われ、pH が 7 未満の状態を表すこともあります。
- 酸性溶液
- 溶液のpHが7未満の状態。酸性の性質を持つ溶液のことを指し、Ba(OH)2 の反対概念として挙げられます。
- 低pH
- pHが7未満の状態を指します。酸性であることの指標として用いられます。
- 中性
- pHが約7の状態。酸性でもアルカリ性でもない中立的な状態で、Ba(OH)2 の対極となる概念の一つです。
- 酸性物質
- 酸性の性質を持つ物質。Ba(OH)2 の反対の性質を持つ物質として考えられます。
ba(oh)2の共起語
- 水酸化バリウム
- Ba(OH)2 の日本語表記。バリウムの水酸化物で、固体は白色。水に溶けて強いアルカリ性を示す。
- バリウム水酸化物
- Ba(OH)2 の別称。化学実験や産業用途で使われる水酸化物。
- アルカリ土類金属
- Ba はアルカリ土類金属の仲間。アルカリ土類元素は水と反応して水酸化物を作りやすい性質がある。
- 強塩基
- Ba(OH)2 は強い塩基で、水溶液はpHが非常に高くなる。酸性を中和する役割を持つ。
- 水溶性
- 水に比較的高い溶解度を持つため、水溶液として扱われることが多い。
- 白色固体
- 常温で白色の結晶性・粉末状の固体として存在する。
- 水和物
- Ba(OH)2 は水和物として存在する場合があり、Ba(OH)2·nH2O の形で扱われることがある。
- Ba(OH)2·8H2O
- 最も一般的な水和物の一形態。実験室でよく用いられる。
- 用途:中和剤
- 強アルカリ性を利用して酸性の水溶液を中和する目的で使われる。
- 用途:分析化学の試薬
- 分析実験の試薬として用いられる場面がある。
- 酸と反応して塩を作る
- 酸性溶液と反応して塩と水を作る中和反応の一例として挙げられる。
- BaSO4沈殿
- 硫酸イオンと反応して難溶性のBaSO4沈殿を生むことがあり、分析・実験で利用される/検出反応の一部となることがある。
- 硫酸イオン
- Ba(OH)2 と反応する可能性のある陰イオンの一つ。分析での識別反応などで関連語になる。
- 危険性・取り扱い
- 強アルカリ性で皮膚・目を刺激する可能性があるため、取り扱いには注意が必要。
- 保護具
- 取り扱い時には手袋・保護眼鏡・実験衣などの保護具を着用する。
- 保管方法
- 乾燥した密閉容器に保管し、酸・酸性溶液と接触しないよう管理する。
- pH
- 水溶液は強アルカリ性を示し、pH が高くなることが多い。
- 化学式
- Ba(OH)2 はその化学式で表される水酸化物の代表例。
ba(oh)2の関連用語
- Ba(OH)2
- バリウム水酸化物の化学式。白色の固体で、強いアルカリ性を示す無機化合物。
- バリウム水酸化物
- Ba(OH)2の日本語名。水に溶けて強アルカリ性の水溶液を作る。
- バリウム
- 元素。原子番号56の金属元素。Ba(OH)2の Ba 成分。
- 水酸化物イオン
- OH-. 水分子が解離してできる陰イオン。アルカリ性の源。
- アルカリ性
- 水溶液がpH7より高い性質。Ba(OH)2は溶液中で非常に強いアルカリ性を示す。
- 強アルカリ/強塩基
- 水溶液のpHが非常に高く、皮膚や目を刺激しやすい性質。取り扱い時は保護具が必要。
- 中和反応
- 酸と水酸化物が反応して水と塩を作る反応の総称。例: Ba(OH)2 + 2HCl → BaCl2 + 2H2O
- 硫酸イオン定性反応
- Ba2+とSO42-が反応して BaSO4 の白色沈殿を生じる検出法。硫酸イオンの検出に使われる。
- Ba(OH)2·8H2O
- 水和物の一種。実験室で広く使われる八水和物の形。
- モル質量
- Ba(OH)2の分子量は約171.34 g/mol。モル計算の基礎として覚えておくと便利。
- 溶解度/水溶性
- 水に溶けやすく、溶液は強いアルカリ性になる。温度により溶け方が変わることがある。
- 安全性/危険性
- 強アルカリ性で皮膚・目を刺激。吸入・摂取は危険。適切な保護具・換気・保管が必要。
- 用途・用途別の使い道
- 排水処理の薬品、化学反応の中和・pH調整、硫酸イオンの定性・定量分析、産業・研究のアルカリ源として使用。



















